허들 높아지는 암질심…퇴짜 맞는 신약 늘어나나
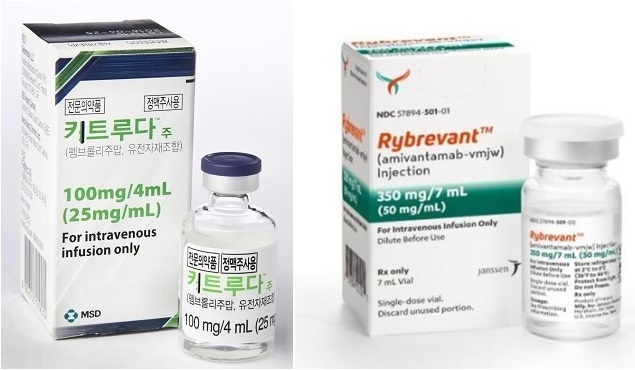
메디칼타임즈=문성호 기자"재정 부담이 큰 치료제는 당분간 쉽지 않을 것 같다."정부의 신약 평가 기조를 둘러싼 변화를 두고서 제약업계의 관심이 집중되고 있다. 당분간 건강보험 재정 부담이 큰 치료제의 급여 적용이 쉽지 않을 것이란 평가마저 나오고 있다. 최근 글로벌 제약사 위주 신약 등재 및 급여 확대 추진에 '제동'이 걸리는 사례가 늘어나고 있기 때문이다.왼쪽부터 한국MSD 키트루다, 얀센 리브리반트 제품사진이다. 4월 열린 암질심 회의에서 두 품목 모두 급여기준 설정에 실패했다.19일 제약업계에 따르면, 최근 건강보험심사평가원은 올해 3번째 중증(암)질환심의위원회(이하 암질심)를 열고 안건으로 올라온 주요 치료제들의 급여 기준 설정 여부를 평가했다.이날 암질심은 지난 2월 10기 위원들로 새롭게 재구성된 뒤 두 번째 열린 회의. 가장 큰 관심을 모은 치료제는 키트루다(펨브롤리주맙, 한국MSD)와 리브리반트(아미반타맙, 얀센)였다. 키트루다의 경우는 15개에 이르는 적응증을 일괄로 급여확대를 신청했다는 점에서, 리브리반트는희소 폐암 치료제인 것과 국산 신약인 렉라자(레이저티닙, 유한양행)와 병용요법으로 활용되고 있다는 이유에서 주목을 받았다.하지만 이들 두 치료제 모두 급여기준 설정에 실패했다.우선 키트루다의 경우 자궁내막암 등 15개 암종에서 급여기준 설정에 실패했는데, 암질심은 재정분담안 추가 제출 시 급여기준 설정 여부를 재논의하겠다는 단서를 남겼다.즉 한국MSD에 기존보다 더 큰 재정분담을 요구한 것이다. 참고로 지난해부터 이어진 암질심 회의와 이번 보류 결정에 차이점이 있다면 일괄로 '급여기준 미설정' 판단을 내렸다는 것이다. 기존까지는 15개 적응증 별로 나눠 '재논의'로 결정을 내려왔기 때문이다. 1월 열린 암질심 회의에서도 심평원은 적응증별 의학적 타당성 검토 후 제약사 재정분담안을 제출받아 재논의하기로 결정한 바 있다. 즉 15개 적응증 개별마다 의학적 타당성을 분석한 후 급여확대 여부를 평가하겠다는 뜻이다.실제로 임상현장에서도 암질심이 한국MSD가 신청한 15개 적응증 중 임상3상 데이터를 보유한 적응증부터 논의할 것으로 예상해왔다. 현재 15개 적응증 중 8개 적응증에서 임상 3상 데이터를 보유하고 있다.암질심 위원이었던 A대학병원 종양내과 교수는 "15개 적응증을 한꺼번에 심사할 수는 없다. 3상 임상결과 유무에 따라 차이가 있는데, 해당 결과가 없는 적응증도 많다"며 "3상 결과가 있어야 정확한 가치를 평가할 수 있다. 적응증 마다 치료성적 혹은 임상결과에 따른 대조군과의 차이가 존재하기 때문에 이를 우선적으로 볼 줄 알았다"고 평가했다. 그는 "하지만 이번 암질심에서는 일괄적으로 키트루다 급여확대 신청을 보류했다"며 "논의 기조가 최근 들어 변화된 것 아니냐는 의견이 나오는 이유"라고 말했다.올해 4월까지의 신규 등재 및 급여기준 확대 품목 현황이다. 4000억원 이상의 건보 재정이 투입되면서 4개월 만에 지난해 치료제 급여 적용 활용된 전체 금액을 넘어선 모습이다.여기에 희소폐암으로 분류되는 'EGFR 엑손20 삽입 변이 비소세포폐암' 치료제인 '리브리반트까지 암질심 세 번째 도전에서도 '실패'를 경험해야 했다. 리브리반트의 경우 국내 임상현장에서의 존재감이 한층 커지고 있는 치료제다. 리브리반트와 함께 동일 암종에 허가 받은 '엑스키비티(모보서티닙)'가 지난해 확증 임상시험의 실패로 향후 행보가 불투명하기 때문이다.동시에 렉라자와 짝을 이루는 병용요법으로 국내 활용의 기대감이 커지고 있는 상황에서 이번 급여기준 설정 실패는 더 주목받을 만하다. 반면, 폐암 시장에서 경쟁 중인 타그리소의 경우 단독요법 뿐만 아니라 항암화학요법 병용까지 국내 허가를 받으면서 국내 시장 진출에 속도를 내고 있다.렉라자와 타그리소 두 품목의 경우 추가적인 급여 적용 시 약가인하를 또 감내해야 한다는 점에서 리브리반트의 급여적용은 필수적이다. 타그리소의 경우 짝을 이루는 항암 화학요법은 환자부담이 크지 않다는 점에서 렉라자+리브리반트는 대비된다고 볼 수 있다.이 가운데 제약업계에서는 올해부터 새롭게 구성된 10기 암질심으로 운영된 후 신약 급여평가 기조가 달라진 것 같다는 의견을 내놓고 있다. 다시 말해, 앞으로 신약의 급여기준 설정이 더 어려워진 것 아니냐는 반응이다.새 암질심 위원으로 임명된 또 다른 대학병원 종양내과 교수는 "최근 논의 과정을 살펴봤을 때 건강보험 재정 부담이 크게 늘어나는 품목에 대해서는 쉽지 않을 것 같다"며 "상대적으로 고가인 치료제의 경우 회사의 재정적인 부담 규모를 새롭게 설정해야 할 것"이라고 귀띔했다.